Награду разделили между тремя героями, которые в 1970-е показали, что при расшифровке структуры молекулы можно использовать одновременно как квантово-механический подход, так и методы классической физики.
Нобелевская премия по химии в этом году досталась Мартину Карплюсу (Martin Karplus), Майклу Левитту (Michael Levitt) и Ари Уоршелу (Arieh Warshel) за метод, позволяющий описать химическую молекулу одновременно с классических и с квантово-механических позиций.
Кто, или Конь и Лань
Мартин Карплюс родился в Австрии в 1930 году, учёную степень получил в Калифорнийском технологическом институте (США), сейчас работает одновременно в Страсбургском университете (Франция) и в Гарварде (США). Майкл Левитт родом из Южной Африки, где родился в 1947 году, учился в Кембридже (Великобритания), нынче трудится в Стэнфордском университете (США). Ну а Ари Уоршел, 1940 года рождения, получивший учёную степень в Институте Вейцмана (Израиль), работает в Южно-Калифорнийском университете (США). Прежде чем рассказать, чем отличился каждый из лауреатов, следует пояснить, почему их работа столь важна для науки.
За последний полвека химия сделала впечатляющий рывок вперёд, и, как многие полагают (и небезосновательно), львиная доля достижений приходится на биохимию (включая сюда и молекулярную биологию). Подавляющее большинство биохимических реакций выполняются белками, а без представления об их структуре часто просто невозможно понять, что и как они в той или иной реакции делают. Множество лабораторий по сей день занимаются расшифровкой белковых структур, используя стандартные методы рентгеноструктурного анализа кристаллов и ядерно-магнитного резонанса, позволяющего рассмотреть атом или группу атомов, которые не удаётся «поймать» в кристалле. Однако такие технологии далеко не всегда опираются только на экспериментальные данные, и, чтобы рассчитать параметры структуры, соответствующим программам приходится обращаться к теоретическим соотношениям, описывающим силы и взаимодействия между атомами и группами атомов в пределах молекулы.

Мартин Карплюс
С другой стороны, внимание химиков и биологов постепенно стало смещаться от вопроса «На что это похоже?» к вопросу «Как это работает?». Настала пора посмотреть на расшифрованные структуры в действии; однако эта задача часто оказывается не по плечу экспериментальным методам исследования. Можно, например, введя в реакцию в качестве метки изотоп, проследить за его судьбой и тем самым сделать какие-то выводы о работе реагирующих молекул. Однако в той же биохимии приходится иметь дело сразу с несколькими взаимосвязанными реакциями, и такую сложную конструкцию чисто экспериментальный «глаз» охватить уже не в состоянии. Тут на помощь экспериментатору приходит как раз теория, которая позволяет, например, охарактеризовать такие состояния фермента и субстрата, которые в эксперименте увидеть невозможно — настолько они нестабильны.

Майкл Левитт
В общем, понятно, что чем дальше, тем больше исследователи нуждались в теоретических методах, которые помогали бы понять, как ведут себя молекулы в химических реакциях. Однако в химических (и особенно в биохимических) реакциях всё происходящее можно разделить как бы на две сферы. С одной стороны, происходит перегруппировка электронов, которые отрываются от одних атомов и переходят к другим (разумеется, мы вовсе не сводим к этой грубой формулировке всю ту невероятную чехарду, которую в химических реакциях демонстрируют электроны и ядра атомов). С другой стороны, если говорить, например, о ферментах, то это массивные молекулы, части которых движутся относительно друг друга, захватывая в каталитический центр одни вещества, выпуская из себя другие и т. д. Часто, чтобы описать работу фермента или огромного надмолекулярного комплекса вроде рибосомы, используют механико-машинные эпитеты. Если же забыть на время про белки и взять молекулы попроще, то в этом случае мы представляем себе реакцию между ними так: летели две молекулы навстречу друг другу, летели — и столкнулись, а столкнувшись, прореагировали.

Ари Уоршел
То есть, если вспомнить про физику, тут у нас сталкиваются классическая физика частиц и квантовые представления о материи. Классические, не квантовые взаимодействия научились моделировать давно, благо эти модели гораздо проще, чем квантовые, и в химии классические модели нашли широкое применение. Однако со временем стало понятно, что при описании химических систем нужно учитывать ещё и квантовые принципы.
Здесь можно было бы воскликнуть вслед за классиком, что «В одну телегу впрячь не можно / Коня и трепетную лань», если под «трепетной ланью» понимать квантовые выверты электронов, а под «конём» — классическую физику, однако лауреатское трио 2013-го как раз и занималось тем, что запрягало в одну телегу, то бишь в одну модель, классические и квантовые представления. И сделало оно это весьма успешно, коль скоро Нобелевский комитет счёл нужным...
В своих трудах Карплюс, Левитт и Уоршел показали, как в рамках одной модели совместить классические и квантовые физические принципы: часть химической системы (например, каталитический центр белка с субстратом) описывается с помощью квантового моделирования, другая же часть (молекулярная машина, поддерживающая каталитический центр) представляется на физическом языке, который рассматривает атомы и группы атомов как классические частицы. Кроме того, тут учитывалось окружение, среда, в которой находится химическая система (работающий фермент). Главной особенностью такого моделирования стало именно то, что удалось состыковать квантовую и классическую части, причём стыковка не была сугубо математическим упражнением, а имела конкретный физический смысл.
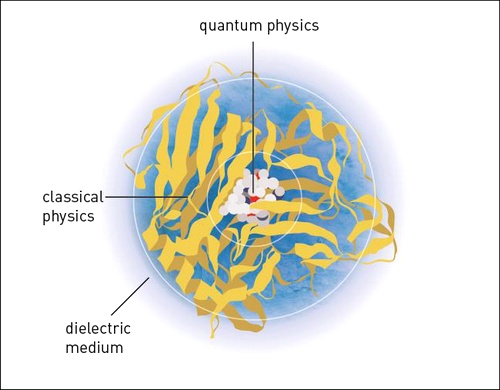
Молекула фермента, в которой работу каталитического центра следует оценивать квантово-механическими методами, остальную часть молекулы можно рассматривать как набор классических заряженных частиц, и всё это нужно соотносить с диэлектрической средой (вода)
Немного истории
История квантово-химических представлений о веществе начинается со славных имён Планка, Бора, де Бройля, Гейзенберга, Шрёдингера и Дирака, каждый из которых, кстати говоря, в своё время получил Нобелевскую премию. После них квантовый подход попытались применить к расшифровке структуры молекулы. Однако квантовым попыткам предшествовали классические, рассматривавшие молекулы как набор простых заряженных частиц. В 1946 году сразу несколько групп разработали метод моделирования, учитывавший кулоновские и ван-дер-ваальсовы силы для оценки внутримолекулярных взаимодействий. Этот подход позволял представить такую структуру, которая обладала минимальной энергией и, следовательно, была наиболее стабильной.
В конце концов исследователи научились рассчитывать силы окружения, влияющие на молекулу, но вот насчёт того, к чему эти силы приводят, мнения разделились. Окружение должно благоприятствовать определённой структуре молекулы, и одни, к примеру, Норман Аллингер (Norman Allinger), говорили, что нужно просто рассчитать минимум энергии в таком окружении, чтобы получить единственно возможную структуру молекулы, другие же, скажем, Немети (G. Némety) и Шерага (H. Scheraga), использовали статистический метод, чтобы иметь набор молекулярных конформаций, кои с точки зрения статистики обладали одинаковой вероятностью. Кроме того, методы, рассматривавшие атомы как простые заряженные частицы и описывавшие их взаимодействия силами Кулона и Ван-дер-Ваальса, позволяли легко оценить энергию большой и относительно стабильной молекулы; однако такие методы оказывались непригодны для представления химической реакции, в ходе которой из реагентов появлялась новая молекула. Чтобы описать, как молекулы появляются и разрушаются, нужен был именно квантово-механический подход.
Нынешние лауреаты создали методику, с которой стратегия выбора молекулярной конформации не имела значения. Их подход оценивал как изменения в энергии, которые случались как большие пространственные перестройки, затрагивающие целые части молекулы, так и изменения в электронной конфигурации. И те и другие оценивались относительно окружения молекулы, которое полагалось стабильным. Рассчитывать, исходя из уравнения Шрёдингера, все энергетические изменения, происходящие в какой-нибудь биомолекуле, нельзя, потому что квантовые расчёты молекулы такой величины съедят любой компьютер. Так что оставалось лишь соединить классические представления о заряженных частицах и их взаимодействиях с квантовыми — и понять, как соединить одно с другим.
Как ковалась победа
Первый шаг в этом направлении был сделан, когда в начале 1970-х Ари Уоршел навестил в Гарварде Мартина Карплюса: первый к этому времени приобрёл опыт в оценке классических внутри- и межмолекулярных потенциалов; второй занимался квантово-химическими расчётами. Вместе они написали программу, которая довольно точно представляла поведение пи-электронов в ряде плоских молекул. Программа оценивала влияние ядер атомов и других электронов в молекуле (сигма-электронов) как классических частиц, а на пи-электроны смотрела уже с квантово-механических высот.
Именно эта работа и стала первым доказательством того, что успешная комбинация двух подходов, классического и квантового, вполне возможна. Но было одно ограничение: программа хорошо работала только с плоскими молекулами, в которых пи- и сигма-связи отделены друг от друга (благодаря чему электроны сигма-связи и можно рассматривать как классические заряженные частицы). Но тонкость эта не была принципиальной, что и продемонстрировано в работе 1976 года, где Ари Уоршел и Майкл Левитт показали в общем виде, как можно отделить «классические» электроны от «квантовых».
Между этими двумя трудами вышла ещё одна важная статья, в которой Уоршел и Левитт рассмотрели, как их комбинированный метод работает на особо больших молекулах. Исследователи попытались «свернуть» молекулу белка, приняв боковые цепи аминокислот за большие псевдоатомы, единые крупные частицы, квантовыми процессами внутри которых можно пренебречь. Такое упрощение позволяло ускорить структурирование (то есть моделирование) макромолекулы.
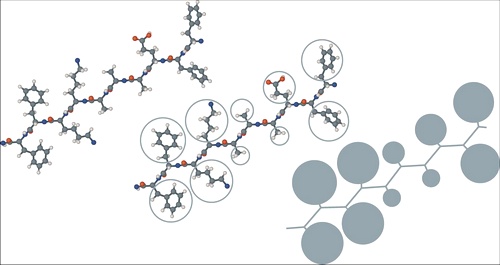
Полипептид, в котором боковые цепи аминокислот представлены «псевдоатомами»
Итак, нынешние нобелевские лауреаты не просто показали, что в любой молекуле можно определить, какую её часть допустимо рассматривать с точки зрения классических взаимодействий между заряженными частицами, а какую — с точки зрения квантово-механических процессов; они также сумели согласовать обе части и привязать их к среде, в которой молекула существует. Слово multiscale («многошкальный»), которое встречается в формулировке Нобелевского комитета, как раз и отражает способность метода работать сразу в нескольких координатах.
Напомним, что Ари Уоршел, Майкл Левит и Мартин Карплюс создавали свой гибридный метод в конце 60-х — начале 70-х годов прошлого века, так что их находки уже давно используются в науке. Комитет отмечает работу лауреатов в том числе и как выдающийся пример соединения теории и практики. Однако, учитывая методологическую смелость исследований, можно сказать, что этот тот самый случай, когда премия достаётся открытию, имеющему, кроме чисто научного, ещё и философское значение.












